



湖北日報訊(記者張真真)10月13日,武漢凱德維斯生物技術有限公司(以下簡稱“凱德維斯”)宣布,其自主研發的一類創新藥KDTV001注射液新藥臨床試驗申請,已獲中國國家藥品監督管理局批準,實現全球首創。同時,這一藥物臨床試驗申請也于9月26日遞交至美國食品藥品監督管理局(FDA),并已進入審評階段。
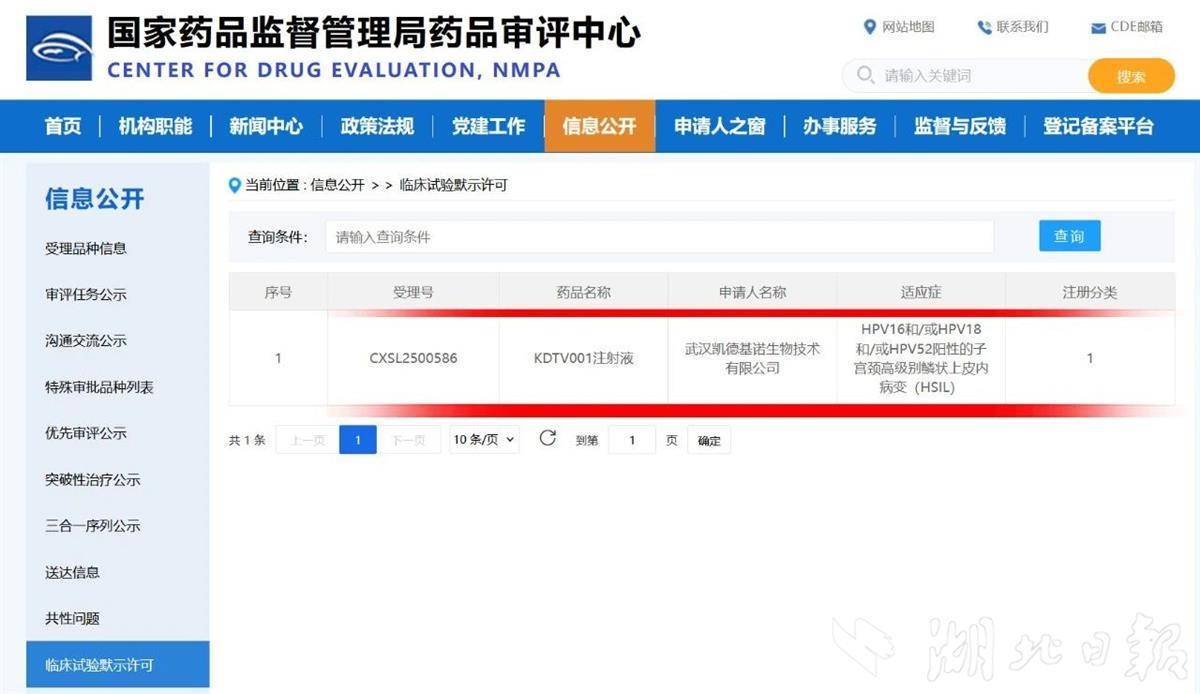
本次在中國獲批的KDTV001注射液,為主動免疫類治療用生物制品,將首先開展一項Ⅰ期臨床研究,旨在評估該注射液在HPV16/18/52陽性的子宮頸高級別鱗狀上皮內病變成年女性患者中的安全性、耐受性、免疫原性及初步療效。
子宮頸癌是嚴重威脅全球女性健康的惡性腫瘤,在我國發病率高居第二位。2020年全球估計有60.4萬例女性被診斷出患有宮頸癌,約34.2萬例女性死于宮頸癌。
世界衛生組織發布的《加速消除宮頸癌全球戰略》中明確提出,90%的確診婦女應得到治療。
高危型人乳頭瘤病毒(HPV)持續感染是宮頸癌及癌前病變的主要驅動因素。尤其需警惕的是,子宮頸高級別鱗狀上皮內病變(CIN2/3)的臨床風險,是其最重要的癌前階段。已有權威研究數據證實,未經治療的CIN3患者在30年內有30%-50%會發展為子宮頸癌,且隨著病程延長,這一風險還可能進一步累積,凸顯了對子宮頸高級別鱗狀上皮內病變進行早期、有效干預的緊迫性。

KDTV001注射液,將主要針對晚期實體瘤、早期非浸潤性腫瘤、HPV感染導致的宮頸高級別鱗狀上皮內病變等適應癥。該注射液由凱德維斯旗下承擔生物創新藥物研究與開發的武漢凱德基諾生物技術有限公司負責研發。

凱德維斯是與華中科技大學同濟醫學院附屬同濟醫院和馬丁院士團隊聯合打造的國家級專精特新“小巨人”企業,已申請51項專利,含發明專利48項、實用性新型專利3項,并建立了從研發到生產的高效活病毒載體基因治療藥物全棧式平臺,確保藥物安全、有效、質量可控。2023年,其基因治療藥物重組溶瘤病毒KD01獲得國家藥品監督管理局批準,已進入Ⅰ期臨床。
Copyright ? 2001-2025 湖北荊楚網絡科技股份有限公司 All Rights Reserved
互聯網新聞信息許可證 4212025003 -
增值電信業務經營許可證 鄂B2-20231273 -
廣播電視節目制作經營許可證(鄂)字第00011號
信息網絡傳播視聽節目許可證 1706144 -
互聯網出版許可證 (鄂)字3號 -
營業執照
鄂ICP備 13000573號-1  鄂公網安備 42010602000206號
鄂公網安備 42010602000206號
版權為 荊楚網 www.cnhubei.com 所有 未經同意不得復制或鏡像